 发布时间:2025-06-28
发布时间:2025-06-28
随着全球微创市场的不断扩大,影像类产品的合规准入要求也越来越复杂,企业如何精准把握不同目标市场的法规要求,成为产品出海的关键。2025年6月26日,远方公司联合UL美华、捷闻医疗成功举办“影像类医疗器械全球合规准入研讨会”。会议聚焦全球市场准入策略与国际检测标准,众多行业代表参与,共议新形势下全球合规挑战与机遇。
远方检测总经理陈聪为本次研讨会致辞。他表示,在当前国内市场日益内卷的大环境下,了解并掌握医疗器械全球准入规则对企业扬帆出海、行稳致远至关重要,并希望通过此次研讨会各方可以增进交流、细化分工、通力合作,共同面向全球医疗器械市场。

远方检测总经理陈聪博士致辞
会议期间,专家们深度解析了影像类医疗器械国际准入法规、认证要求、检测技术以及产品整改要点等。
捷闻医疗副总经理徐冉生动讲解了影像类医疗器械产品在欧美澳加巴等主要国际出口市场的法规要求及差异,并介绍了注册流程及最新动态,同时提供了面向全球主要医疗器械市场的国际注册思路。

捷闻医疗副总经理徐冉作报告
远方检测医疗器械光学实验室经理文菊深度解析了关于影像类医疗器械产品检测的ISO等国际标准,并重点介绍了光学性能检测项目,同时比较了国内外标准的差异,助力企业提升产品全球合规性。

远方检测医疗器械光学实验室经理文菊作报告
UL美华认证专家曹倬铭探讨了医疗器械一体化审核程序(简称MDSAP计划)的全球适用性及其在巴西等新兴市场准入中的关键作用,为企业提供高效合规路径。

UL美华认证专家曹倬铭作报告
最后,特邀机构通鉴科技技术总监史昌兵围绕有源类医疗器械产品EMC整改策略等痛点,分享了系统性解决方案,为企业降本增效提供新思路。

特邀机构通鉴科技技术总监史昌兵作报告
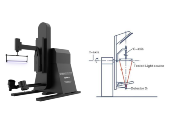
会议期间,参会代表实地参观了远方检测实验室,近距离观摩由远方公司研发制造的影像类医疗器械检测设备,并了解标准化检测流程及检测技术,加深了对专业检测服务的了解。
与会代表参观远方检测实验室
本次研讨会,通过国际法规介绍、检测标准解读、案例分享与检测技术展示,为影像类医疗器械企业构建全球化合规体系提供全方位支持。远方检测实验室已通过中国国家认证认可监督管理委员会资质认定(CMA 200015344411)和中国合格评定国家认可委员会资质认可(CNAS L5831),后续将持续以专业检测能力为基石,携手行业伙伴共促医疗健康产业创新发展。

影像类医疗器械全球合规准入研讨会合影留念

















































































































































































































































































































































































 返回列表
返回列表











 远方公众号
远方公众号
